SMALL

중합도 - 고분자의 한 사슬에 단량체가 결합된 수
반응 전환율 - 단량체를 넣었을 때 폴리머 전환되는 비율
평균 분자량 26,000의 C10H14N2O4S2의 DP?
[원자량] C = 12 H = 1 N = 14 O = 16 S = 32, [MW(몰질량)] = 290
평균 분자량 / 몰질량 = 중합도
26,000/290 = 90
위 문제의 경우에서 고분자에 의한 반응 전환율(DP)은 얼마인가?
DP = 90
90 = 1/1-p
p = 0.99
따라서 반응 전환율은 0.99이다.
평균 분자량은 2가지 종류가 있습니다.
고분자의 경우 분자량 크기의 분포를 가집니다.
모노머가 반응하는 정도에 따라 사슬의 길이(중량)가 달라지기 때문입니다.
따라서 고분자를 분자량을 이야기할 때는 평균 분자량을 이용합니다.
평균 분자량을 알아보기 전 알아야 할 것
시료의 몰수를 n (단위: mol),
시료의 질량을 W (단위: g),
시료의 분자량(= 몰질량)을 M (단위: g/mol)이라 할 때,
이들 사이의 기본 관계식은 다음과 같다.
▶ n = W / M
- 수평균 분자량
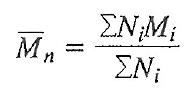
Ni :분자몰수 Mi : 분자량
분자량 30,000을 갖는 A 고분자 9g과, 50,000 을 갖는 B 고분자 5g 이루어졌을 때, Mn은 얼마인가?
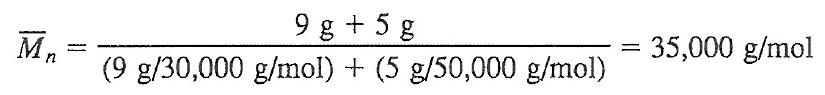
수평균 분자량 = 분자몰수 x 분자량 / 분자몰수
분자몰수 x 분자량 = 질량
분자몰수 = 질량/분자량
- 중량평균 분자량
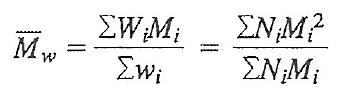
Ni :분자몰수
Mi : 분자량
wi : 시료 질량
중량평균 분자량 같은 경우 고분자의 길이(중량)이 평균 분자량에 크게 반영됩니다.
길이가 작은 폴리머는 평균 분자량에 작게 반영되고 길이가 긴 폴리머는 평균 분자량에 크게 반영되기 때문에
중량평균 분자량은 수 평균 분자량보다 항상 같거나 큰 값을 가집니다.
분자량 30,000을 갖는 A 고분자 9g과, 50,000 을 갖는 B 고분자 5g 이루어졌을 때, Mw 구하시오

중량평균 분자량 = 시료 질량 x 분자량 / 시료 질량
- 다분산도
Mw /Mn - 분자량의 분포를 확인
다분산도가 1에 가까울수록 고분자들 간의 크기 차가 적음을 알 수 있습니다.
LIST
'배터리 정보' 카테고리의 다른 글
| 수소연료전지: 탄소중립을 위한 발걸음 (59) | 2024.04.08 |
|---|---|
| NCM 양극재(삼원계 배터리) VS LFP 양극재 (0) | 2024.02.18 |
| 리튬이온배터리 음극 소재 (4) | 2023.12.02 |
| 배터리 구성 & 용어 (2) | 2023.11.26 |
| 폴리머와 배터리 (0) | 2023.11.25 |



